-
L’action Disc Medicine (IRON.US) recule de plus de 7% après un article de Reuters.
-
La FDA suspend temporairement l’examen du bitopertin, principal candidat médicament du groupe.
-
Les régulateurs pointent des doutes sur la méthodologie des essais cliniques et un potentiel risque d’abus.
-
La décision finale est reportée au 10 février 2026, un signal d’alerte pour les investisseurs.
-
L’épisode remet en question l’efficacité du programme accéléré de validation des médicaments lancé par l’administration Trump.
-
L’action Disc Medicine (IRON.US) recule de plus de 7% après un article de Reuters.
-
La FDA suspend temporairement l’examen du bitopertin, principal candidat médicament du groupe.
-
Les régulateurs pointent des doutes sur la méthodologie des essais cliniques et un potentiel risque d’abus.
-
La décision finale est reportée au 10 février 2026, un signal d’alerte pour les investisseurs.
-
L’épisode remet en question l’efficacité du programme accéléré de validation des médicaments lancé par l’administration Trump.
Les actions de Disc Medicine ont subi une forte pression vendeuse ce jeudi, perdant plus de 7% après la publication d’un article de Reuters mettant en lumière un revers réglementaire majeur. En cause : la décision de la Food and Drug Administration (FDA) de suspendre l’examen du bitopertin, le médicament phare du laboratoire, dans le cadre de son programme d’approbation accélérée.
🧪 Suspension du bitopertin : les détails de la décision de la FDA
Un programme accéléré plus strict que prévu
Le bitopertin était examiné dans le cadre du FDA Commissioner’s National Priority Voucher Program, un dispositif dévoilé en juin 2025 par l’administration Trump. Ce programme promettait des décisions réglementaires en un à deux mois, soit un gain de 4 à 6 mois par rapport aux procédures prioritaires classiques.
Cependant, la FDA a décidé de mettre en pause l’examen du dossier de Disc Medicine et de reporter sa décision de deux semaines, jusqu’au 10 février 2026. Pour le marché, ce report constitue un signal négatif clair, indiquant que l’approbation est loin d’être acquise.
Des réserves sur la méthodologie des essais
Le premier point de blocage concerne la méthodologie des études cliniques. Les régulateurs s’interrogent sur la pertinence de l’un des critères secondaires, à savoir le « temps passé sans douleur dans un environnement extérieur détendu ».
Selon la FDA, ce critère pourrait davantage refléter un bien-être psychologique lié à des conditions agréables qu’un bénéfice thérapeutique mesurable. L’agence exige donc des données supplémentaires basées sur des biomarqueurs, afin de démontrer que la baisse des métabolites toxiques se traduit bien par un avantage clinique tangible pour les patients.
⚠️ Risque d’abus et implications réglementaires
Une évaluation complémentaire du potentiel addictif
Le second point d’inquiétude est plus sensible encore. Les équipes de la FDA chargées de la classification des substances à potentiel addictif mènent actuellement des analyses supplémentaires sur le bitopertin. L’objectif est d’évaluer un éventuel risque de mésusage ou d’abus.
Reuters n’a pas été en mesure de confirmer la nature exacte de ce risque. Toutefois, de telles investigations peuvent déboucher sur des restrictions strictes de prescription et de distribution, ce qui pèserait lourdement sur le potentiel commercial du médicament.
Un signal d’alerte pour les investisseurs
Historiquement, lorsque la FDA soulève des doutes sur la robustesse des données cliniques ou sur un risque d’abus, le processus d’approbation a tendance à s’allonger. Pour les investisseurs, cette suspension accroît significativement l’incertitude réglementaire autour du dossier Disc Medicine.
🌐 Un problème sectoriel plus large
Sanofi également touché
Disc Medicine n’est pas un cas isolé. Presque simultanément, Reuters a révélé la suspension de l’examen du Tzield de Sanofi (SAN.FR), destiné au traitement du diabète de type 1. Dans ce cas, la situation est encore plus préoccupante, la FDA évoquant des décès de patients et des effets indésirables graves comme des crises d’épilepsie et des complications thromboemboliques.
Ces décisions successives montrent que le programme de vouchers, initialement perçu comme une voie rapide vers le marché, se révèle bien plus exigeant que prévu.
Un programme accéléré sous surveillance
À ce jour, un seul médicament, un antibiotique générique, a été approuvé via ce programme, alors que la FDA avait annoncé en octobre 2025 la participation de 18 médicaments. La majorité des examens sont désormais repoussés à 2026, voire 2027-2028, ce qui refroidit l’enthousiasme initial des investisseurs.
📉 Réaction du marché et analyse technique
La défense du titre mise à l’épreuve
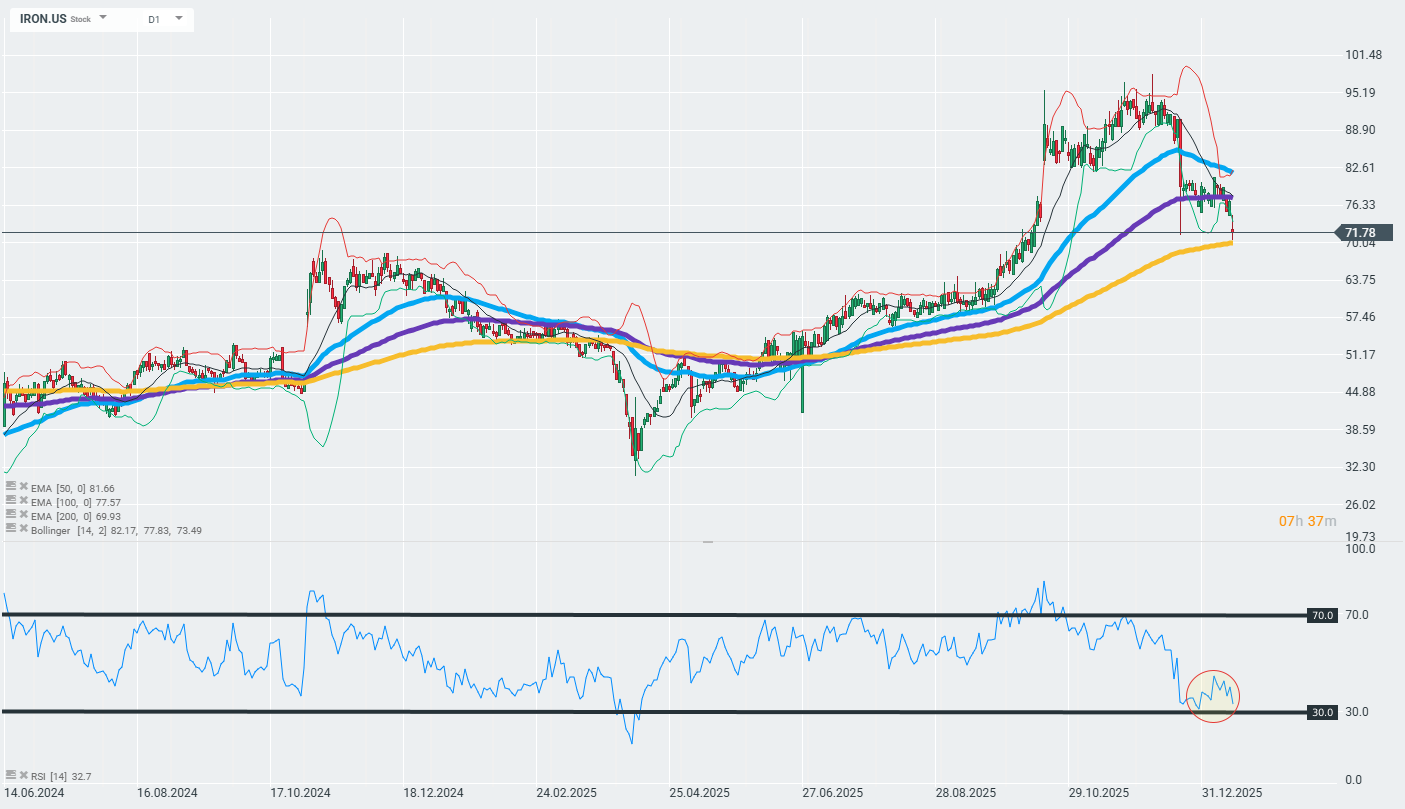
Source: xStation
Malgré les déclarations rassurantes de John Quisel, PDG de Disc Medicine, qui évoque un profil de sécurité solide et des bénéfices cliniques multiples, le marché reste sceptique. Le titre a chuté vers des zones de support techniques majeures, proches de la moyenne mobile exponentielle à 200 jours.
Ce niveau technique sera déterminant pour la suite. Un maintien au-dessus pourrait favoriser un rebond technique, tandis qu’une cassure nette risquerait de prolonger la tendance baissière.
Un avertissement pour le secteur biotechnologique
Au-delà du cas Disc Medicine, cet épisode rappelle que la FDA ne sacrifiera pas ses exigences scientifiques, même sous pression politique. Pour l’ensemble du secteur biotechnologique et pharmaceutique, cela implique une réévaluation du risque réglementaire, en particulier pour les sociétés misant sur des procédures accélérées.
❓ FAQ
Pourquoi l’action Disc Medicine chute-t-elle aujourd’hui ?
Elle recule après la suspension par la FDA de l’examen du bitopertin, soulevant des doutes sur son efficacité et son potentiel risque d’abus.
Le report de la décision est-il définitif ?
Non, la décision est repoussée au 10 février 2026, mais ce délai pourrait n’être qu’une première étape d’un processus plus long.
Le programme d’approbation accélérée de la FDA est-il remis en cause ?
Oui, les récentes suspensions montrent qu’il est beaucoup plus strict que ce que les marchés anticipaient.
Quels sont les principaux risques pour Disc Medicine ?
Un allongement du calendrier réglementaire, des restrictions potentielles de distribution et une incertitude accrue sur le potentiel commercial du bitopertin.
Ce cas peut-il affecter d’autres biotechs ?
Oui, il pourrait conduire les investisseurs à être plus prudents vis-à-vis des sociétés dépendantes d’approbations accélérées.

Les actions Paramount Skydance sous pression après l'avertissement de S&P

Broadcom, dernier géant technologique. Qu'attendre de ses résultats ?

Nvidia confrontée à de nouvelles restrictions concernant le H200 en Chine

Ouverture US : Wall Street dans le sang
"Ce contenu est une communication marketing au sens de l'art. 24, paragraphe 3, de la directive 2014/65 /UE du Parlement européen et du Conseil du 15 mai 2014 concernant les marchés d'instruments financiers et modifiant la directive 2002/92 /CE et la directive 2011/61 /UE (MiFID II). La communication marketing n'est pas une recommandation d'investissement ou une information recommandant ou suggérant une stratégie d'investissement au sens du règlement (UE) n°596/2014 du Parlement européen et du Conseil du 16 avril 2014 sur les abus de marché (règlement sur les abus de marché) et abrogeant la directive 2003/6 / CE du Parlement européen et du Conseil et directives 2003/124 / CE, 2003/125 / CE et 2004/72 / CE de la Commission et règlement délégué (UE) 2016/958 de la Commission du 9 mars 2016 complétant le règlement (UE) n°596/2014 du Parlement européen et du Conseil en ce qui concerne les normes techniques de réglementation relatives aux modalités techniques de présentation objective de recommandations d'investissement ou d'autres informations recommandant ou suggérant une stratégie d'investissement et pour la divulgation d'intérêts particuliers ou d'indications de conflits d'intérêt ou tout autre conseil, y compris dans le domaine du conseil en investissement, au sens de l'article L321-1 du Code monétaire et financier. L’ensemble des informations, analyses et formations dispensées sont fournies à titre indicatif et ne doivent pas être interprétées comme un conseil, une recommandation, une sollicitation d’investissement ou incitation à acheter ou vendre des produits financiers. XTB ne peut être tenu responsable de l’utilisation qui en est faite et des conséquences qui en résultent, l’investisseur final restant le seul décisionnaire quant à la prise de position sur son compte de trading XTB. Toute utilisation des informations évoquées, et à cet égard toute décision prise relativement à une éventuelle opération d’achat ou de vente de CFD, est sous la responsabilité exclusive de l’investisseur final. Il est strictement interdit de reproduire ou de distribuer tout ou partie de ces informations à des fins commerciales ou privées. Les performances passées ne sont pas nécessairement indicatives des résultats futurs, et toute personne agissant sur la base de ces informations le fait entièrement à ses risques et périls. Les CFD sont des instruments complexes et présentent un risque élevé de perte rapide en capital en raison de l'effet de levier. 75% de comptes d'investisseurs de détail perdent de l'argent lors de la négociation de CFD avec ce fournisseur. Vous devez vous assurer que vous comprenez comment les CFD fonctionnent et que vous pouvez vous permettre de prendre le risque probable de perdre votre argent. Avec le Compte Risque Limité, le risque de pertes est limité au capital investi."


