Akcje Disc Medicine (IRON.US) spadły dzisiaj o ponad 7% po publikacji artykułu Reuters dotyczącego przyspieszanego programu zatwierdzania leków FDA. Głównym powodem spadku jest wstrzymanie przeglądu regulacyjnego flagowego leku firmy – bitopertin – z powodu poważnych wątpliwości dotyczących skuteczności i ryzyka nadużyć. Decyzja regulatorów odsunięta została o dwa tygodnie, do 10 lutego 2026 roku, co stanowi wyraźny sygnał ostrzegawczy dla rynku kapitałowego.
Co się stało – szczegóły decyzji FDA
FDA wstrzymała przegląd bitopertin w ramach FDA Commissioner's National Priority Voucher Program – programu przyspieszonych zatwierdzeń leków zaprezentowanego przez administrację Trumpa w czerwcu 2025 roku. Program miał obiecywać decyzje regulacyjne w zaledwie 1-2 miesiące, co stanowiłoby skrócenie standardowego procesu priorytetowego aż o 4-6 miesięcy.
Bitopertin to eksperymentalny lek opracowywany dla pacjentów z rzadką chorobą krwi, która powoduje ekstremalną wrażliwość na światło słoneczne. Regulatorzy wskazali trzy kluczowe problemy w dokumentacji regulacyjnej:
Pierwsze zastrzeżenie – metodologia badań: FDA kwestionuje, czy "czas bez bólu w warunkach relaksacyjnych, na świeżym powietrzu" – drugi cel z badań klinicznych – stanowi statystycznie solidny miernik skuteczności leku, czy może bardziej pokazuje, że pacjenci psychicznie lepiej czują się w warunkach dla nich przyjemnych. Agencja domaga się dodatkowych danych opartych na biomarkerach, aby potwierdzić, że spadek toksycznego metabolitu rzeczywiście przekłada się na mierzalne korzyści terapeutyczne dla pacjentów.
Drugie zastrzeżenie – potencjał nadużyć: Pracownicy FDA zajmujący się klasyfikacją leków o potencjale uzależniającym przeprowadzają dodatkowe badania bitopertin pod kątem możliwości jego niewłaściwego użytku. Reuters nie mógł potwierdzić szczegółów dotyczących potencjału nadużyć, ale ostrzeżenia regulatorów mogą prowadzić do nałożenia specjalnych restrykcji na dystrybucję leku.
Kontekst – problemy szersze niż sama Disc Medicine
Disc Medicine nie jest osamotniona. Prawie równocześnie Reuters ujawnił, że również Sanofi (SAN.FR) – francuski gigant farmaceutyczny – musiał zmierzyć się z wstrzymaniem przeglądu swojego leku Tzield (przeznaczonego do leczenia cukrzycy typu 1). Wstrzymanie Tzield jest jeszcze bardziej alarmujące, bowiem FDA powołuje się na śmierć pacjenta związaną z leczeniem oraz na poważne zdarzenia niepożądane, takie jak seizury (w grudniu 2024 r. i wrześniu 2025 r.) oraz powikłania zakrzepowo-zatorowe (maj 2025 r.).
Program voucherów Trumpa okazuje się znacznie bardziej rygorystyczny, niż początkowo sądzono. Zaledwie jeden lek – generyczny antybiotyk – otrzymał zatwierdzenie w ramach programu, mimo że od października 2025 roku FDA ogłosiła, że 18 leków będzie uczestniczyć w przyspieszonym procesie akceptacji. Większość przeglądów ma rozpocząć się w 2026 roku, z dwoma dodatkowymi zaplanowanymi na 2027-2028.
Stanowisko Disc Medicine i implikacje
John Quisel, CEO Disc Medicine, stwierdził w rozmowie z Reutersem, że dane bitopertin wykazują "solidny profil bezpieczeństwa i wiele korzyści medycznych". Wskazał on na znaczący spadek toksycznego metabolitu (główny cel dwóch badań mid-stage) oraz zmniejszenie fototoksycznych reakcji u pacjentów.
Jednak optymizm CEO nie zatrzymał spadku akcji. Dla inwestorów, wstrzymanie przez FDA jest jasnym sygnałem ryzyka – oznacza, że zatwierdzenie nie jest pewne, a kolejne dwa tygodnie (do 10 lutego) mogą być tylko początkiem procesu. Historia pokazuje, że gdy regulatorzy podnoszą znaki zapytania związane z metodologią badań czy potencjałem nadużyć, droga do zatwierdzenia często się wydłuża.
Implikacje dla sektora
Ten incydent ma znaczenie dla całego sektora biotechnologicznego i farmaceutycznego. Program voucherów był postrzegany przez inwestorów jako potencjalnie szybka ścieżka do zysków dla wybranych firm. Dzisiejsze wstrzymania pokazują jednak, że FDA nie będzie robić rzeczy "na skróty" – niezależnie od politycznych nacisków czy obietnic przyspieszenia.
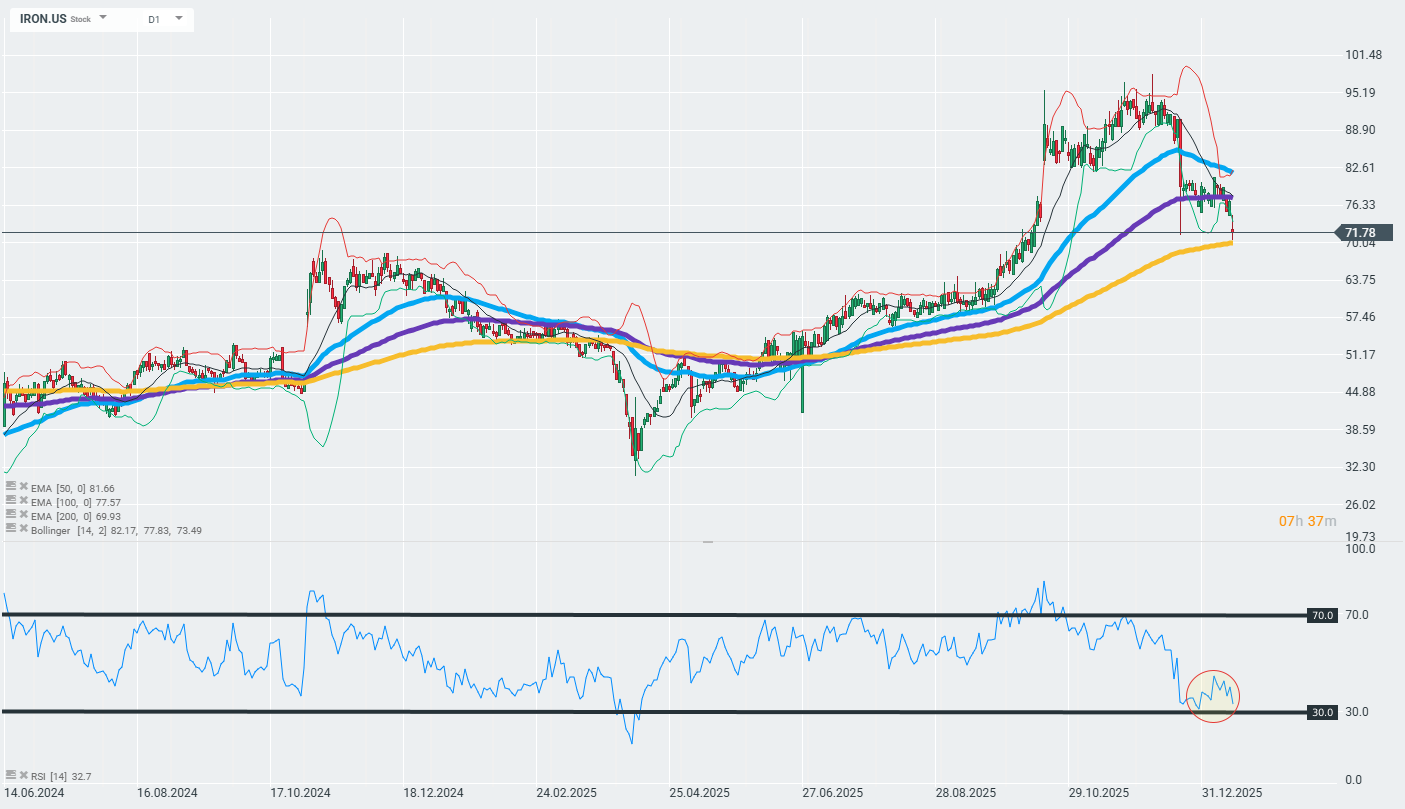
Akcje spółki dzisiaj mocną tracą i schodzą w strefy ważnych wsaprć technicznych wyznaczonych przez 200-dniową wykładnicża średnią kroczącą (złota krzywa na wykresie). Dalsza reakcja na tę strefę może zadecydować, czy obecny trend zdoła się utrzymać, czy będziemy jednak obsewować jego odwrócenie.
Źródło:xStation

Arista Networks zamyka 2025 rok rekordowymi wynikami!

Podsumowanie dnia: Srebro traci 9% 📉Indeksy, kryptowaluty i metale pod presją

📉US100 traci 1,5%

Czy obecna wyprzedaż oznacza zmierzch spółek kwantowych?
Ta publikacja handlowa jest informacyjna i edukacyjna. Nie jest rekomendacją inwestycyjną ani informacją rekomendującą lub sugerującą strategię inwestycyjną. W materiale nie sugerujemy żadnej strategii inwestycyjnej ani nie świadczymy usługi doradztwa inwestycyjnego. Materiał nie uwzględnia indywidualnej sytuacji finansowej, potrzeb i celów inwestycyjnych klienta. Nie jest też ofertą sprzedaży ani subskrypcji. Nie jest zaproszeniem do nabycia, reklamą ani promocją jakichkolwiek instrumentów finansowych. Publikację handlową przygotowaliśmy starannie i obiektywnie. Przedstawiamy stan faktyczny znany autorom w chwili tworzenia dokumentu. Nie umieszczamy w nim żadnych elementów oceniających. Informacje i badania oparte na historycznych danych lub wynikach oraz prognozy nie stanowią pewnego wskaźnika na przyszłość. Nie odpowiadamy za Twoje działania lub zaniechania, zwłaszcza za to, że zdecydujesz się nabyć lub zbyć instrumenty finansowe na podstawie informacji z tej publikacji handlowej. Nie odpowiadamy też za szkody, które mogą wynikać z bezpośredniego czy też pośredniego wykorzystania tych informacji. Inwestowanie jest ryzykowne. Inwestuj odpowiedzialnie.


