As ações da Disc Medicine (IRON.US) caíram mais de 7% hoje, após um artigo da Reuters sobre o programa de aprovação acelerada de medicamentos da FDA. A principal razão para o declínio é a suspensão da revisão regulatória do medicamento principal da empresa, o bitopertin, devido a sérias preocupações sobre a sua eficácia e risco de abuso. A decisão dos reguladores foi adiada por duas semanas, para 10 de fevereiro de 2026, o que é um claro sinal de alerta para o mercado de capitais.
O que aconteceu – detalhes da decisão da FDA
A FDA suspendeu a sua análise da bitopertina no âmbito do Programa Nacional de Vouchers Prioritários do Comissário da FDA — um programa de aprovação acelerada de medicamentos revelado pela administração Trump em junho de 2025. O programa prometia decisões regulatórias em apenas 1 a 2 meses, o que encurtaria o processo de prioridade padrão em até 4 a 6 meses.
A bitopertina é um medicamento experimental em desenvolvimento para pacientes com uma doença sanguínea rara que causa extrema sensibilidade à luz solar. Os reguladores identificaram três questões principais na documentação regulatória:
Primeira reserva — metodologia de investigação: A FDA questiona se o «tempo sem dor num ambiente relaxado ao ar livre» — o segundo objetivo dos ensaios clínicos — é uma medida estatisticamente robusta da eficácia do medicamento ou se simplesmente mostra que os pacientes se sentem melhor mentalmente em condições que são agradáveis para eles. A agência está a solicitar dados adicionais baseados em biomarcadores para confirmar que a diminuição dos metabolitos tóxicos realmente se traduz em benefícios terapêuticos mensuráveis para os pacientes.
Segunda preocupação – potencial de abuso: A equipa da FDA responsável pela classificação de medicamentos com potencial viciante está a realizar estudos adicionais sobre a bitopertina para avaliar o seu potencial de uso indevido. A Reuters não conseguiu confirmar detalhes sobre o potencial de abuso, mas os avisos dos reguladores podem levar a restrições especiais na distribuição do medicamento.
Contexto – questões mais amplas do que a própria Disc Medicine
A Disc Medicine não está sozinha. Quase simultaneamente, a Reuters revelou que a Sanofi (SAN.FR), gigante farmacêutica francesa, teve de enfrentar a suspensão da revisão do seu medicamento Tzield (destinado ao tratamento da diabetes tipo 1). A suspensão do Tzield é ainda mais alarmante, uma vez que a FDA cita mortes de pacientes associadas ao tratamento e eventos adversos graves, como convulsões (em dezembro de 2024 e setembro de 2025) e complicações tromboembólicas (maio de 2025).
O programa de vouchers de Trump está a revelar-se muito mais rigoroso do que se pensava inicialmente. Apenas um medicamento — um antibiótico genérico — foi aprovado ao abrigo do programa, apesar de a FDA ter anunciado em outubro de 2025 que 18 medicamentos participariam no processo de aprovação acelerada. A maioria das revisões está prevista para começar em 2026, com duas adicionais planeadas para 2027-2028.
Posição e implicações da Disc Medicine
John Quisel, CEO da Disc Medicine, disse à Reuters que os dados da bitopertina mostram «um perfil de segurança sólido e múltiplos benefícios médicos». Ele apontou para uma diminuição significativa nos metabolitos tóxicos (o desfecho primário de dois estudos em fase intermediária) e uma redução nas reações fototóxicas nos pacientes.
No entanto, o otimismo do CEO não impediu a queda das ações. Para os investidores, a suspensão da FDA é um sinal claro de risco — o que significa que a aprovação não é certa e que as próximas duas semanas (até 10 de fevereiro) podem ser apenas o início do processo. A história mostra que, quando os reguladores levantam questões sobre a metodologia de pesquisa ou o potencial de abuso, o caminho para a aprovação muitas vezes se torna mais longo.
Implicações para o setor
Este incidente é significativo para todo o setor de biotecnologia e farmacêutico. O programa de vouchers era visto pelos investidores como um potencial atalho para lucros para empresas selecionadas. No entanto, as suspensões de hoje mostram que a FDA não vai cortar custos, independentemente da pressão política ou das promessas de aceleração.
As ações da empresa estão a perder terreno hoje e a cair em importantes zonas de suporte técnico marcadas pela média móvel exponencial de 200 dias (a curva dourada no gráfico). A reação futura a esta zona pode determinar se a tendência atual continuará ou se veremos uma reversão.
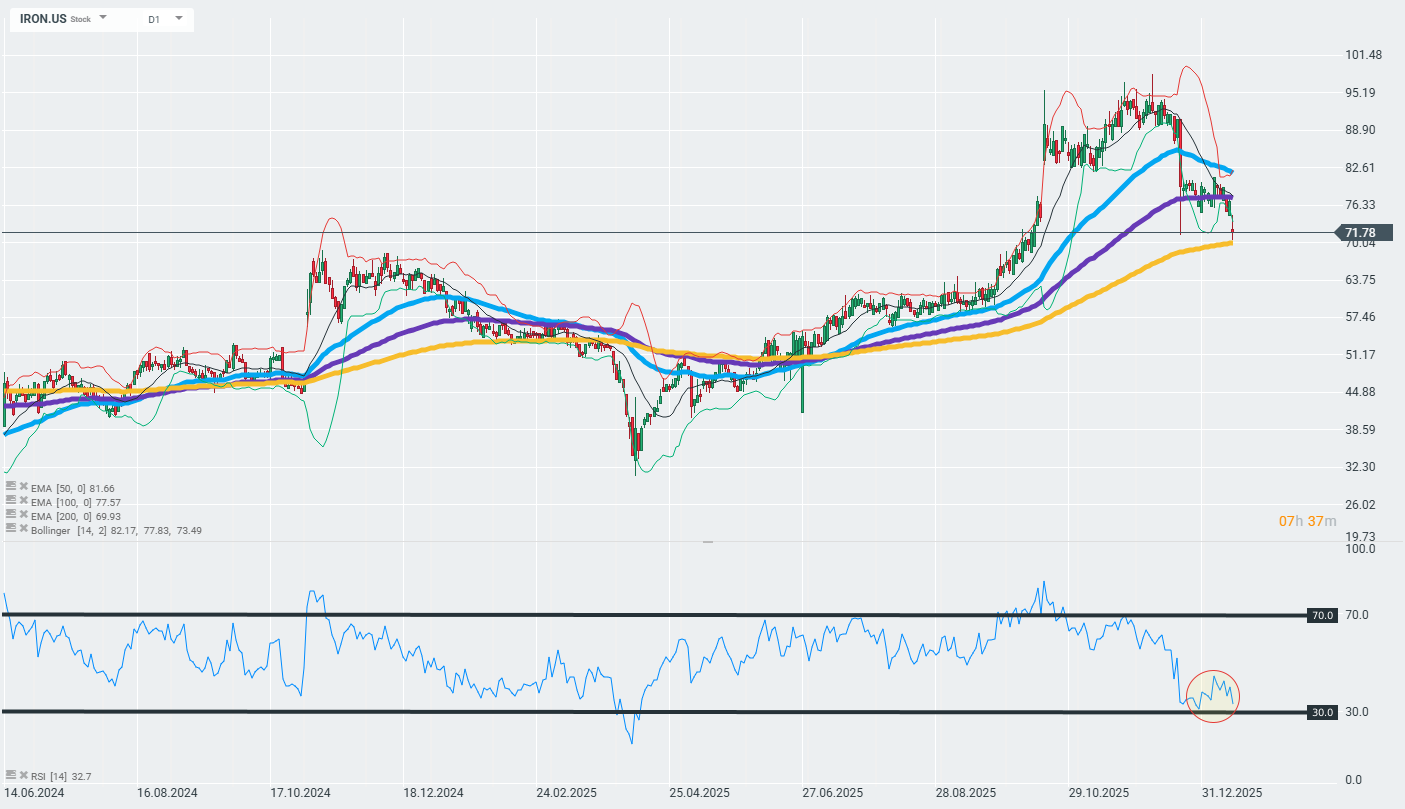
Fonte: xStation

Ação da semana: Broadcom

Como os Conflitos Geopolíticos Mexem com os Mercados: Setores que Ganham e Perdem

Destaques do mercado: Índices tentam recuperar apesar dos preços do petróleo🗽Broadcom dispara

📀Coinbase e MicroStrategy disparam depois de Trump desafiar os bancos
Este material é uma comunicação de marketing na aceção do artigo 24.º, n.º 3, da Diretiva 2014/65 / UE do Parlamento Europeu e do Conselho, de 15 de maio de 2014, sobre os mercados de instrumentos financeiros e que altera a Diretiva 2002/92 / CE e Diretiva 2011/61/ UE (MiFID II). A comunicação de marketing não é uma recomendação de investimento ou informação que recomenda ou sugere uma estratégia de investimento na aceção do Regulamento (UE) n.º 596/2014 do Parlamento Europeu e do Conselho de 16 de abril de 2014 sobre o abuso de mercado (regulamentação do abuso de mercado) e revogação da Diretiva 2003/6 / CE do Parlamento Europeu e do Conselho e das Diretivas da Comissão 2003/124 / CE, 2003/125 / CE e 2004/72 / CE e do Regulamento Delegado da Comissão (UE ) 2016/958 de 9 de março de 2016 que completa o Regulamento (UE) n.º 596/2014 do Parlamento Europeu e do Conselho no que diz respeito às normas técnicas regulamentares para as disposições técnicas para a apresentação objetiva de recomendações de investimento, ou outras informações, recomendação ou sugestão de uma estratégia de investimento e para a divulgação de interesses particulares ou indicações de conflitos de interesse ou qualquer outro conselho, incluindo na área de consultoria de investimento, nos termos do Código dos Valores Mobiliários, aprovado pelo Decreto-Lei n.º 486/99, de 13 de Novembro. A comunicação de marketing é elaborada com a máxima diligência, objetividade, apresenta os factos do conhecimento do autor na data da preparação e é desprovida de quaisquer elementos de avaliação. A comunicação de marketing é elaborada sem considerar as necessidades do cliente, a sua situação financeira individual e não apresenta qualquer estratégia de investimento de forma alguma. A comunicação de marketing não constitui uma oferta ou oferta de venda, subscrição, convite de compra, publicidade ou promoção de qualquer instrumento financeiro. A XTB, S.A. - Sucursal em Portugal não se responsabiliza por quaisquer ações ou omissões do cliente, em particular pela aquisição ou alienação de instrumentos financeiros. A XTB não aceitará a responsabilidade por qualquer perda ou dano, incluindo, sem limitação, qualquer perda que possa surgir direta ou indiretamente realizada com base nas informações contidas na presente comunicação comercial. Caso o comunicado de marketing contenha informações sobre quaisquer resultados relativos aos instrumentos financeiros nela indicados, estes não constituem qualquer garantia ou previsão de resultados futuros. O desempenho passado não é necessariamente indicativo de resultados futuros, e qualquer pessoa que atue com base nesta informação fá-lo inteiramente por sua conta e risco.


